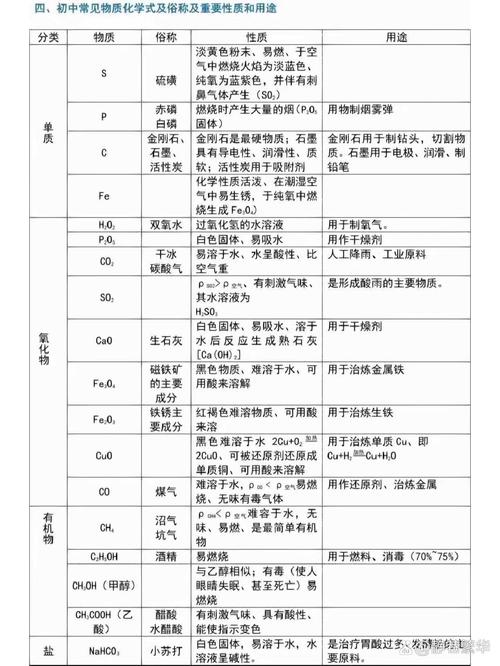
化学中酸碱的种类
〖One〗、常见的酸有:HCl(盐酸)、H2SO4(硫酸)、H3PO4(磷酸)、HClO(次氯酸)、HF(氢氟酸)、HCN(氢氰酸)、H2SO3(亚硫酸)、HClO4(高氯酸)、HNO3(硝酸)、HNO2(亚硝酸)。这些酸的共同特点是它们的分子式以H开头。碱:定义为电离出的阴离子只有OH-的化合物称为碱。
〖Two〗、在初中化学中,酸、碱和盐是基础且常见的物质类别。酸类物质主要包括硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、磷酸(H3PO4)、氢硫酸(H2S)、碳酸(H2CO3)和醋酸(乙酸,CH3COOH)等。这些酸在不同环境中具有不同的化学性质,比如可以与金属反应释放氢气,或者与碱反应生成水和盐。
〖Three〗、在高中化学中,强酸主要包括硫酸(H2SO4)、硝酸(HNO3)和盐酸(HCl)。而强碱则有氢氧化钠(NaOH)、熟石灰(氢氧化钙,化学式:Ca(OH)2)以及氢氧化钡(Ba(OH)2)。弱酸方面,常见的有碳酸(H2CO3)、氢硫酸(H2S)和硼酸(H2BO3)。
〖Four〗、碱:常见的碱包括氢氧化钠、氢氧化钙2)、氢氧化钾等。它们具有碱性特性,如能使指示剂变色,能与酸发生中和反应等。 盐:盐是酸和碱反应生成的物质,例如氯化钠、硫酸铜、碳酸钠等。它们具有特定的化学性质,如有些盐在溶液中能发生水解反应,有些盐能与某些物质发生复分解反应等。
怎样学初中化学酸碱盐这部分?
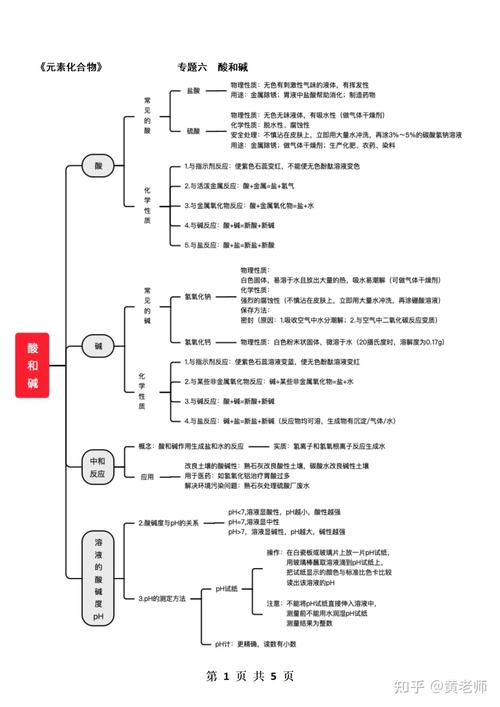
〖One〗、学习酸碱盐的化学性质,如酸碱反应生成盐和水,盐与酸或碱的反应等。学习ph的概念:ph是衡量溶液酸碱性的指标,ph值小于7为酸性,等于7为中性,大于7为碱性。学习如何使用ph试纸或ph计来测量溶液的ph值。进行实验操作:通过实验室实验来观察酸碱盐的反应,如酸碱中和反应、盐的沉淀反应等。
〖Two〗、这部分是最难的,考试的重点是推断、化学式书写、方程式的书写、计算等。个人认为先从化合价表开始背起,特别是离子符号及所带的电性要背熟;其次是熟练书写化学式,并能根据正负离子组合成化学式;再就是酸碱盐的通式要知道,要会区分,注意醇(-OH)类分开。
〖Three〗、通过溶液导电性实验,我们能够理解某些化合物的干燥晶体不具备导电性,但在溶解于水中时却能够导电。这个实验帮助我们初步理解酸、碱、盐的基本概念。酸、碱、盐的导电性差异,为我们进一步学习它们的性质奠定了基础。
〖Four〗、学习初中化学中的酸碱盐,需要付出一定的努力。首先,务必熟记酸的五条通性、碱的四条通性、盐的四条通性,以及金属活动性顺序表和盐的溶解性表。这些基础知识一旦掌握,许多问题就能迎刃而解。了解一些反应的实质,比如复分解反应的条件。我个人认为,不必刻意去背这些条件,通过多做题自然就能掌握。
什么前十制盐法要记住吗?(科学化学方程式)
〖One〗、酸碱盐溶解性口诀:钾钠铵盐都可溶、硝酸盐遇水影无踪、盐酸盐不溶氯化银、硫酸盐不溶硫酸钡、溶碱钾钠铵和钡、氢氧化钙微溶水。 微溶物质:氢氧化钙、硫酸钙、硫酸银、碳酸镁。(请在表中找出上述物质,注明溶解性)复分解反应的条件:生成物中有沉淀、气体 或 水 ,必须具备三者之一。
〖Two〗、SO3+H2O==H2SO4 初中制盐的方法:酸加碱生成盐;酸和盐反应生成新盐;碱和盐反应生成新盐;盐和盐反应生成新盐;酸性氧化物和碱生成盐;碱性氧化物和酸生成盐。
〖Three〗、工业制烧碱化学方程式:2NaCl+2HO==电解==2NaOH+H↑+Cl↑ 正极产生氯气,负极产生氢气,所得溶液为NaOH溶液。隔膜电解法将原盐化盐后加入纯碱、烧碱、氯化钡精制剂除去钙、镁、硫酸根离子等杂质,再于澄清槽中加入聚丙烯酸钠或苛化麸皮以加速沉淀,砂滤后加入盐酸中和。
〖Four〗、工业上生产烧碱的方法,近来有有苛化法、电解法和离子交换膜法。苛化法 将纯碱、石灰分别经化碱制成纯碱溶液、石灰制成石灰乳,于99~101℃进行苛化反应,苛化液经澄清、蒸发浓缩至40%以上,制得液体烧碱。将浓缩液进一步熬浓固化,制得固体烧碱成品。
〖Five〗、“工业盐”这种提法不科学。在工业化时代之前,人们所说的盐,特指生活中调味用的食盐,而不是现在化学科学中的“盐”。然而现实生活中,相当数量的人文化水平不太高,分不清生活中的“食盐”和化学中的“盐”实质上的差别,以至发生多起误食有毒盐类,发生群体中毒的事件。

化学实验室基础与常识:常用酸碱盐性质汇总
氢氧化钾性质类似,为白色固体,易溶于水,放出大量热,强碱,有强腐蚀性,易溶于甲醇、乙醇。这些酸碱盐的性质是化学实验安全与成功的基石。在使用时,需根据实验需求与安全规程正确选用,避免误操作导致的危险与损失。
首先是盐酸,HCl,它的分子量为3463,沸点110℃。这无色液体以其18~19 g·mL-1的密度和36~38%的质量分数表现出强烈的酸性。作为溶剂,它能溶解大多数金属氯化物,且Cl-离子具有弱还原性和一定的络合作用。
通过溶液导电性实验,了解某些化合物的干燥晶体不导电,溶于水时可导电。 从有些化合物水溶液能导电的现象入手,了解电离。 了解常见的酸,碱,盐的电离方程式。 理解酸,碱,盐的初步概念。 掌握盐酸,稀硫酸的化学性质及有关的化学方程式,了解它们的用途。
性质:与碱反应,与碱性氧化物反应,与活泼金属反应,与盐溶液反应。使石蕊变红 碱:强碱NaOH,KOH,Ba(OH)2 中强碱LiOH,Ca(OH)2,AgOH(常温分解===Ag2O+H2O)弱碱:大部分难溶性的碱 性质:与酸反应,与酸性氧化物反应,与盐溶液反应。使石蕊变蓝,酚酞变红。

化学酸碱盐之间的反应怎么学?
记住化学方程式是学习化学反应的基础,掌握酸碱盐之间的反应规律和生成物规律是必要的。 在初中化学学习中,要将知识与生活实际相结合,深入理解并应用到日常生活中。 学习化学需要耐心和细心,不断积累常识,并将其融入生活中,这样才能更好地理解和掌握化学知识。
首先,要记住常见物质的化学式,比如氢氧化钠、硫酸、氯化钠等,这些是基础。其次,了解酸碱盐的常见反应特点,比如酸和碱反应生成盐和水,酸和金属反应生成盐和氢气,等等。第三,掌握常见物质之间的反应规律,例如酸可以和碳酸盐反应生成二氧化碳气体,碱可以和某些非金属氧化物反应生成水。
酸碱盐之间的反应在初中化学中主要表现为复分解反应。书写方程式时,只需将反应物前后位置互换即可。例如,碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH。记住书后不溶物表有助于理解沉淀现象。需要注意的是,硝酸根离子与所有金属离子都会生成可溶性盐,无需特别关注。
酸碱盐的常识和酸碱盐的重要知识点的介绍到此就结束了,如果能碰巧解决你现在面临的问题,别忘了关注本站,如果你还想了解更多这方面的信息,记得收藏关注本站,更多关于酸碱盐的重要知识点的信息别忘了在本站进行查找喔。








还木有评论哦,快来抢沙发吧~